JRRS若手優秀論文賞 受賞論文
JRRS若手優秀論文賞 エントリー論文
研究紹介
Our Research 2024
優秀論文賞対象期間(2023/10/12~2024/09/13)
No. 2024-7 永田 健斗
量子科学技術研究開発機構 放射線医学研究所放射線影響予防研究部 主任研究員
Luminal progenitor and mature cells are more susceptible
than basal cells to radiation-induced DNA double-strand breaks
in rat mammary tissue.
Kento Nagata, Mayumi Nishimura, Kazuhiro Daino, Yukiko Nishimura, Yuya Hattori, Ritsuko Watanabe, Daisuke Iizuka, Akinari Yokoya, Keiji Suzuki, Shizuko Kakinuma, Tatsuhiko Imaoka.
Journal of Radiation Research, rrae064, 2024.
放射線はDNA二重鎖切断を誘発し、これが発がんの起点になると考えられている。ラット乳腺は基底細胞と内腔細胞によって末梢芽状突起(TEB)と乳管が構成されるが、TEBおよび乳管の構造における各細胞のDNA損傷修復動態は不明であった。本研究では、構造と細胞におけるDNA損傷修復動態を明らかにした。まず、7週齢の雌ラットにガンマ線(1Gy)を全身照射し、乳腺パラフィン切片を作製した。基底細胞と内腔細胞の区別には、それぞれ抗サイトケラチン(CK)14抗体と抗CK8+18抗体を用いた。CK8+18による蛍光染色の染色性の違いに基づき、CK8+18弱陽性細胞はKi-67陽性(内腔前駆細胞)、CK8+18強陽性細胞はKi-67陰性(内腔成熟細胞)であり、内腔細胞の分化段階を識別する方法を確立した。次にDNA損傷マーカー53BP1のフォーカスを切片上で細胞種ごとに計数後、フィッティングによるモデル解析を実施し、TEBの基底細胞は2種類の内腔細胞(前駆、成熟)に比べてDSB数が有意に少ないことを見出した。以上のことから、乳腺組織におけるDNA損傷修復動態は、細胞の種類に大きく依存していることが判明した。
No. 2024-6 Chaozhong Tian (田 超中)
東京大学大学院工学系研究科・原子力国際専攻・大学院生(博士課程1年)
Hydroxyl radical scavenging and chemical repair capabilities of positively charged peptides (PCPs): a pulse radiolysis study.
Tian, C., Yamashita, S., Kimura, A., Obata, Y., Yu, H., & Taguchi, M.
Free Radical Research, 58(6–7), 388–395. 2024.
放射線治療において、放射線の治療効果は大きいものの、正常組織への潜在的な害も無視できない。このため正常組織へのダメージを軽減できる防護剤の開発が重要と言える。本研究では、パルスラジオリシス法を用いた放射線防護における正電荷ペプチド(PCP)の応用の可能性について精査した。2種類のPCP(His-Tyr-HisとLys-Tyr-Lys)を用いた。これらのPCPは、その正電荷により負電荷を有するDNAと結合する潜在能力がある。これらのPCPはOHラジカル(ヒドロキシルラジカル)を効果的に消去できた上、化学修復 (chemical repair) というメカニズムでもDNAを保護することを明らかにした。PCPの正電荷を導入には異なる2つの効果が観察された。LysやHisはかさ高いため、PCPの中心にあるTyrのOH捕捉を妨げる遮蔽効果が示された。一方で、正電荷の存在によりおそらくDNAに結合またはDNA近傍での滞在時間が長くなり、化学修復は促進された。PCPのOHラジカル捕捉と化学修復については個別に報告があるものの、本研究はそれらのギャップを埋めるものである。また、今後の新しい放射線防護剤や増感剤の開発に重要な理論的・実験的データを提供するものである。
In radiation therapy, while radiation has significant therapeutic effects, its potential harm to normal tissues cannot be ignored. Therefore, developing protective agents that can reduce damage to normal tissues is particularly vital. This study delves into the potential application of positively charged peptides (PCPs) in radiation protection using pulse radiolysis techniques. In our research, we used two types of PCPs (His-Tyr-His and Lys-Tyr-Lys), whose positive charges have the potential to bind with negatively charged DNA. These peptides effectively scavenge hydroxyl radicals and protect DNA from radiation-induced damage through "chemical repair" mechanisms. Notably, we observed a dual effect following the introduction of positive charges: on one hand, the presence of Lys and His reduced the reaction rate of Tyr with hydroxyl radicals, but on the other hand, the performance of Lys-Tyr-Lys in chemical repair was superior to Tyr, suggesting that the presence of positive charges promotes the chemical repair process. This study fills a gap in the existing literature regarding the direct observation of PCPs' abilities to scavenge hydroxyl radicals and their chemical repair capabilities. It also provides important theoretical and experimental data for the future development of new radiation protective agents and sensitizers.
No. 2024-5 塚田 海馬
オックスフォード大学・MRC分子医学研究所・博士研究員
BLM and BRCA1-BARD1 coordinate complementary mechanisms of joint DNA molecule resolution.
Kaima Tsukada, Samuel E. Jones, Julius Bannister, Mary-Anne Durin, Iolanda Vendrell, Matthew Fawkes, Roman Fischer, Benedikt M. Kessler, J. Ross Chapman, Andrew N. Blackford.
Molecular Cell, 84, 640–658, 2024.
放射線などにより生じるDNA二本鎖切断は最も重篤な種類のDNA損傷の一つであり、これらの修復機構の破綻は細胞のゲノム不安定性へと繋がる。BRCA1遺伝子は相同組み換え(HR)経路を介したDNA二本鎖切断修復へと関わり、家族性乳がん・卵巣がん・前立腺がんの感受性遺伝子としても知られている。現在、BRCA1などHR経路に変異を持つがんには、BRCA-PARP間での合成致死関係に基づき、PARP阻害剤が効果的な分子標的として使用されているが、治療過程での薬剤耐性獲得が問題となっている。本研究では、がん易罹患性や光過敏症などを呈するブルーム症候群の原因遺伝子であるBLMがBRCA1と合成致死の関係を持つことを明らかにした。また、BLM-BRCA1間での合成致死のメカニズムがPARP-BRCA間での合成致死のメカニズムと異なることを突き止めた。本研究成果から、BLMを標的とした阻害剤の開発などにより通常のBRCA1変異がんのみならず、PARP阻害剤耐性を持つBRCA1変異がんも効率的に治療できる可能性が示唆された。

No. 2024-4 加藤 千博
北海道大学大学院獣医学院 応用獣医科学講座 放射線学教室・博士課程4年
Feasibility study of multimodal imaging for redox status and glucose metabolism in tumor.
Kato K, Yasui H, Sato-Akaba H, Emoto MC, Fujii HG, Kmiec MM, Kuppusamy P, Mizuno Y, Kuge Y, Nagane M, Yamashita T, Inanami O.
Free Radical Biology and Medicine, 218: 57-67, 2023.
近年、異なるイメージング法を組み合わせ、複数の生体内機能情報からより正確な診断や治療予後判定を行うマルチモーダルイメージングの重要性が増している。がん細胞の生存や治療抵抗性にレドックス状態が関与しており、エネルギー代謝がレドックスバランスに影響することから、腫瘍のレドックス状態と代謝活性を同一個体で評価することで新たながん治療戦略を見出せる可能性がある。我々が開発した小型の可搬型電子常磁性共鳴イメージング(EPRI)装置を用い、レドックスイメージングで得られた組織の還元力を示すレドックスマップと [18F]FDGのオートラジオグラフィー(ARG)との比較を行った。本装置によってX線照射による腫瘍内のレドックス環境の変化を検出できた。レドックスマップと[18F]FDGのARGとの比較により腫瘍内の還元力が高い領域は糖代謝が活発であることが明らかとなったが、X線照射によってその相関は消失した。以上の結果から、本装置で得られるレドックスマップと[18F]FDGを指標にした糖代謝マップには治療応答に関わる機能情報が含まれ、より詳細な機構解明に繋がる可能性が示唆された。

No. 2024-3 山下 晃矢
北海道大学大学院獣医学院 応用獣医科学講座 放射線学教室・博士課程4年
Mechanism of the Radioresistant Colorectal Cancer Cell Line SW480RR Established after Fractionated X Irradiation.
Koya Yamashita, Hironobu Yasui, Tomoki Bo, Masaki Fujimoto and Osamu Inanami.
Radiation research, 202 (1): 38–50, 2024.
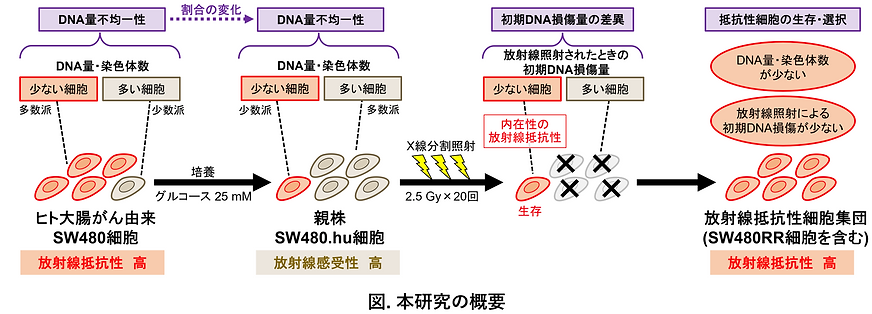
腫瘍内不均一性は治療抵抗性に関与する。本研究では、がん細胞集団のDNA量不均一性に着目し、がんの放射線抵抗性にDNA量不均一性がどのように影響するのか検討した。使用したヒト大腸がん由来SW480細胞は染色体数が異なる2つの細胞集団から主に構成されているが、培地中のグルコースの有無がその割合に大きく影響した。X線分割照射により樹立した放射線抵抗性SW480RR細胞は、親細胞集団内のDNA量が少ない内在性の抵抗性細胞が分割照射の過程で選択されたものであることが明らかになった。DNA修復能の亢進のような抵抗性獲得を示す証拠は得られず、DNA量が少ない細胞で放射線誘導性の初期DNA損傷量がより少なくなることが、この内在性の高い放射線抵抗性の一因と考えられた。本研究は、放射線治療後の放射線抵抗性細胞出現にDNA量不均一性が寄与しうることの実例として、治療抵抗性における腫瘍内DNA量不均一性の潜在的な重要性を示すものである。また、DNA量不均一性のある細胞集団において、異なる放射線感受性を有する細胞の割合が培養環境によって変動したことは、培養がん細胞を用いた研究全般における注意点を示唆する。
No. 2024-2 房 知輝
山形大学医学部 メディカルサイエンス推進研究所 動物実験センター・助教
Heme Biosynthesis is Crucial for Cell Survival and Mitochondrial OXPHOS after X Irradiation.
Tomoki Bo, Koen Van Wijk, Osamu Nakajima.
Radiation research, 201(1):48-54, 2023.
ヘムタンパク質は転写・翻訳に働くものに加え、ミトコンドリア電子伝達系の重要な構成要素として知られる。これまでにX線照射がATP産生などのミトコンドリア機能を亢進することが明らかにされていることから、ヘム生合成が放射線照射後のミトコンドリア機能活性化に寄与している可能性が考えられた。我々はX線照射前後の細胞内ヘム生合成を評価するとともに、Succinyl acetone(SA)によるヘム生合成阻害がX線照射後の細胞生存およびミトコンドリア機能に与える影響を評価した。 はじめにヘム生合成活性を評価したところ、X線照射はヘム生合成律速酵素ALAS1 mRNA発現量および細胞内ヘム量を有意に増加し、これはSA処理により抑制された。次に、SAによるヘム生合成阻害が細胞の放射線感受性に与える影響をコロニー形成法により評価したところ、SA処理は放射線感受性を増強させた。また、SA処理による放射線増感効果はミトコンドリア内ヘムタンパク質の減少を通じてATP産生などのミトコンドリア機能低下に起因すると考えられた。以上の結果から、放射線照射により細胞のヘム生合成が亢進し、ヘム生合成は放射線照射後のミトコンドリア活性化および細胞生存に重要であることが示唆された。
No. 2024-1 房 知輝
山形大学医学部 メディカルサイエンス推進研究所 動物実験センター・助教
Ascorbic Acid Protects Bone Marrow from Oxidative Stress and Transient Elevation of Corticosterone Caused by X-ray Exposure in Akr1a-Knockout Mice.
Tomoki Bo, Hidekazu Nohara, Ken-Ichi Yamada, Satoshi Miyata, Junichi Fujii.
Antioxidants, 13(2), 152, 2024
骨髄細胞は体内で最も放射線感受性であり、他の臓器では一般に許容範囲とされる線量でも損傷を受ける。アスコルビン酸(Asc)は強力な抗酸化物質であり、放射線照射による損傷を軽減することが報告されている。しかし、げっ歯類はAscを合成することができるため、実験動物でAscの効果を厳密に評価することは困難である。この問題を解決するため、我々はAscの合成能力が欠損した(Akr1a-KO)マウスを用いて放射線傷害に対するAscの作用を評価した。 X線 (2 Gy)を全身照射し、白血球数を経時的に測定したところ、X線照射直後に白血球数が顕著に低下し、その後徐々に回復した。Akr1a-KO群ではWT群と比較して白血球数回復が遅延したが、これはAsc投与により回復した。Asc濃度はX線照射後に各組織で低下し、その後上昇に転じた。また、X線照射は下垂体からACTHを放出させ、コルチコステロン分泌を促進する。Akr1a-KO群はWT群と比べて血中ACTH量に差はなかった一方で、血中コルチコステロン量が有意に高かった。高用量のコルチコステロンは傷害性であるため、AscがX線被曝や一過性に上昇したコルチコステロンの細胞傷害作用によって生じる活性酸素に対する抗酸化力を介して骨髄を保護していることが示唆された。

